jتکنیک های جدول تناوبی

سرگذشت جدول تناوبی
به طورکلی پیشرفت شیمی عمومی،ازانتشارجدول طبقه بندی تناوبی عنصرها سرچشمه گرفت.باتوجه به اینکه طبقه بندی در هرزمینه ای مطالعه را آسان می کند.
بدون شک لاووازیه نخستین کسی بود که دراین راه گام برداشت اوعناصررابه دودسته ی کلی فلز ونا فلز تقسیم کرد.اوفلز را عنصری میدانست که در ترکیب بااکسیژن باز تولید میکند.
برسیلوس نیز مانندمانند لاوازیه عناصر رابه دو دسته ی کلی فلرونافلزتقسیم کرد..........
اماوی خواص الکتروشیمیایی را درنظر گرفت.وی معتقد بودکه فلزعنصری است که تمایل به از دست دادن الکترون وتشکیل یون مثبت دارد غیرفلز عنصری است که تمایل به گرفتن الکترون وتشکیل آنیون دارد.
ازسال 1871به بعد شیمیدان برخلاف سیلسوس ولاووازیه که برخواص شیمایی عنصرها تاکید داشتند درمسیر طبقه بندی براساس ارتباط بین جرم اتمی وخواص آنها،کوششهایی به عمل آوردند وتلاش در این راه کم وبیش باموفقیتهایی همراه بود.
تاسال1872شصت وسه عنصر شناخته شده بود وشیمیدان ها به جست وجوی راهایی برا ی مرتب کردن عنصرها پرداختند این جستجوها تاحدی شبیه تحقیق اولیه کپلر بر ای یافتن قاعده هایی بود که حرکات سیاره های منظومه ء شمسی رابه هم مربوط می کند.علاوه برجرمهای اتمی نسبی ،بسیاری ازخواص دیگر عنصرهاوموادمرکب حاصل از آنها تا آن زمان معین شده بود.بعضی از این خواص عبارت بودند از:نقطه ذوب،نقطه جوش،چگالی،رسانایی الکتریکی،رسانایی گرمایی،سختی وضریب شکست.نتیجه آنکه ازسال1870به بعد،اطلات فراوانی درباره ی بسیاری ازعنصرها وخواص آنها به دست آمده بود.
درسال 1829شیمیدان آلمانی یوهان ولفگانگ دوبرینز مشاهده کردکه عنصرها غالبا گروه هایی ازسه عنصرباخواص شیمایی مشابه تشکیل میدهند اوتریادها «به معنی سه تایی ها»رابرای آنها پیشنهادکردومانند«کلر ،برم،و ید»؛«کلسیم،استرونسیم وباریم»و.... .درهر تریاد جرم اتمی عنصر میانی تقریبا میانگین عددی جرمهای دو عنصر دیگر است .ولی بعدها معلوم شد که این مطالب اهمیت چندانی ندارد.
دوشان کورتوآ دانشمند فرانسوی درسال 1862طبقه بندی ویژه ای به نام پیچ تلوریک ارائه داد.اوبرای تنظیم جدول خود،استوانه ای را در نظر گرفت ومحیط آن را به 16 قسمت برابر تقسیم کرد.از هر کدام از آنها خطی عمود بر قاعده ی استوانه عبور داد سپس خطی با شیب 45 درجه ازمحل تقاطع یال اول با قاعده رسم کرد تا یالها رایکی پس ازدیگری قطع کند.آنگاه عنصرهای شناخته شده تاآن زمان را به ترتیب جرم اتمی درمحل تقاطع یالهابا این خط شیب دار،قرار دادومشاهده کرد که عناصری مه بر روی یک یال قرار میگیرند،جرم اتمی آنها به اندازه ی 16 واحد ویا مضربی از آنها با یکدیگر تفاوت دارد،خواص مشلبهی خواهند داشت.دراین طبقه بندی تشابه خواص عنصرهای واقع بریک یال تا عنصربیستم یعنی کلسیم رعایت میشد.مثلا تیتان که در بالای اکسیژن وگوگردقرار میگرفت تشابهی باآنها نداشت.
ادلینگ دانشمند انگلیسی در سال 1864جدولی از عنصرها،در5ستون و15سطر منظم کرد.او دریافته بود که با کنار گذاشتن هیدروژن عناصر دیگر به ترتیب صعودی جرم اتمی کنار یکدیگر قرار می گریند.عناصر واقع در یک سطر خواص مشابهی خواهند داشت.
درسال1865شیمیدان انگلیسی نیولندز،اعلام داشت که عنصرها را میتوان به ترتیب افزایش جرم اتمی یه دنبال هم نوشت.هنگامی که این کار صورت گرفت نظمی شگفت انگیز انجام شد:خواص شیمیایی وفیزیکی مشابه چندبار درفهرست ظاهر شد.او عقیده داشت که ،در کل فهرست عنصرها به طور تناوبی ظا هر می شوند.وی عناصرشتاخته شده تا آن زمان را به ترتیب پشت سرهم در یک ستون چید.وی هیچ توجیهی برای فلزاتی که الان فلزات واسطه می نامیم نداشت.
موفق ترین وموثرترین طرح ،طرح شیمیدان روسی مندلیف بود .مندلیف درسال1871به خصلت گسترده تناوبی که امروزه نیز مورد استفاده قرار میگیردپی برد.مندلیف عنصرها را بر اساس وزن اتمی شان مرتب کرد به همین دلیل در جاهایی بی نظمی هایی مشاهده میشد ومندلیف حدس میزد که شاید در تعیین وزن اتمی اشتباهی شده تا مدت ها بعد موزلی دانشمند انگلیسی با تعریف عدداتمی برای هر عنصر، عناصر را برطبق سبک مندلیف ولی اینبار برحسب افزایش عدد اتمی مرتب وجدول کنونی به دست آمد.
بعدها آقای منوچهر ضیایی جدول حلقوی وحلزونی را ابداع کرد.
مبانی راكتورهای هسته ای
از دوم دسامبر 1942، هنگامی كه اولین
راكتور هسته ای ساخت بشر یك واكنش زنجیره ای خود نگهدار را تولید نمود، تا
کنون چند صد نوع راكتور ساخته شده اند. علیرغم اختلافات ممكن در طراحی،
تعدادی ویژگی عمومی وجود دارند كه در كلیه راكتورها مشترك است. مركز هر
راكتور یك قلب فعال است كه واكنش زنجیره شكافت در آن پایدار می گردد. قلب
فعال دارای(1) سوخت شكافت پذیر كه در حین شكافت منبع اصلی تولید نوترونها
است، (2) ماده كند كننده در صورتیكه نیاز به كند نمودن نوترونها باشد (3)
خنك كننده در صورتیكه گرمای تولید شده بوسیله شكافت نیاز به خروج از قلب
داشته باشد و (4) ماده ساختمانی كه نگهدارنده تمامیت فیزیكی قلب است
ای خوشا قدری طلا از پای تا سر داشتن اندکی الماس حتی قدر یک مول داشتن همچو سدیم از برای عشق ید پرپر شدن چون کلردر سر هوای هاش مثبت داشتن سخت ماندن در قبال مشکلات زندگی نی چو آلکانها هوای شعله در سر داشتن دوستی با دیگران چون عنصر خوب نهم نی چوآرگون منزوی و گوشه گیری داشتن نیکنامی و نجابت چون گروه هشتمین همچو آهن در سر فکر مثبت داشتن همچو همپوشانی سیگما که خیلی محکم است در رسیدن به هدف تصمیم راسخ داشتن
دموکریت در ۵۰۰سال قبل از میلاد اوّلین تحقیقها را در رابطه با اتم انجام داد. البته نتایج آزمایشها او امروزه هیچ کدام مورد قبول نیست اما اصلی ترین گام در راستای تحقیق در رابطه با اتم بود. نام اتم به معنای تجزیه ناپذیر را نیز او انتخاب کرد. نظریها او بسیار ابتدایی بود اما باید توجه داشت که تا زمانی که نمیتوان اتم را به چشم دید صحبت در رابطه با آن نیز تنها حدس است. او بر این عقیده بود که:
نظریهٔ اتمی دالتون: دالتون نظریه اتمی خود را با اجرای آزمایش در هفت بند بیان کرد.
نظریههای دالتون نارساییها و ایرادهایی دارد و اما آغازی مهم بود. مواردی که نظریهٔ دالتون نمیتوانست توجیه کند:
قسمت اول نظریهٔ دالتون تأیید فیلسوف یونانی (دموکریت) بود.
نظریهٔ دالتون از سه قسمت اصلی (قانون بقای جرم - قانون نسبتها معین - قانون نسبتهای چندگانه) میباشد.
مطالعهٔ اتمها و ذرات ریزتر فقط به صورت غیرمستقیم و از روی رفتار (خواص) امکان پذیر است.
اولین ذرهٔ زیراتمی شناخته شده الکترون است. مواردی که به کشف و شناخت الکترون منجر شد:
مدل اتمی تامسون (کیک کشمشی، مدل هندوانه ای یا ژله میوه دار)
۱)هر اتم دارای یک هسته کوچک است که بیشتر جرم اتم در آن واقع است.
۲)هسته اتم دارای بار الکتریکی مثبت است.
۳)حجم هسته در مقایسه با حجم اتم بسیار کوچک است زیرا بیشتر حجم اتم را فضای خالی تشکیل میدهد.
۴)هسته اتم بوسیله الکترونها محاصره شدهاست.
او یکی از محققان موفق در این راه بود که با وجود اشتباه بودن مدل او بازهم در خیلی مکانها مانند انرژی اتمی از آن استفاده میشود.
اطلاعات جدیدی اضافه شد:
همچنین ایشان بر این باور بودند که الکترونها بر روی مدارهایی به دور هستهٔ اتم پیوسته در حال گردش اند و این نظریه علاوه بر نارسا بودن اطلاعات
سودمندی در رابطه با ساختار اتم میدهد , منطور از نارسا بودن این است که شکلهای الکترونها به صورت ناقص ترسیم شده میباشد در حالی که امروزه میدانیم
نظریه کامل تری با نام مد لایهای عرضه شدهاست.
....=== مدل اتمی لایهای === یک مدل اتمی است که امروزه پذیرفته شدهاست ولی هنوز از مدل اتمی بور برای نمایش اتم استفاده میشود در این مدل مانند مدل بور هسته که عمدهٔ جرم اتم را تشکیل داده در مرکز اتم قرار دارد و الکترونها با انرژیهای مختلف به دور هسته در حال گردش هستند با این تفاوت که در این مدل الکترونها به شکل ابری که ابر الکترونی نامیده شدهاست در اطراف هسته اتم ودر فضای بسیار بزرگی که قطر آن ۱۰۰۰۰ برابر قطر هستهٔ اتم است در حرکتند
منبع : سایت ویکی پدیا
1.مدل دموکریت
1. ماده ساختار ذره ای دارد
2. اتم های مواد مختلف شکل های متفاوتی دارند (اتم های مواد ترش لوزی شکل و اتم های آب کروی)
2. مدل دالتون
1. ماده ساختار ذره ای دارد
2. اتم ساچمه مانند و توپر است
3. تفاوت مواد بخاطر شکل اتم های آن ها نیست.
3. مدل تامسون
1. اتم دارای بار منفی به نام الکترون است و به همان اندازه بار مثبت به نام پروتون دارد.
2. الکترون ها در خمیری از بارهای مثبت پخش شده اند مانند کیک کشمشی
4. مدل رادرفورد
1. اتم هسته ای کوچک با بار مثبت دارد
2. بیشتر حجم اتم فضای خالی است
3. الکترون ها اطراف هسته را محاصره کرده اند.
5.مدل بور
1. هسته کوچک با بار مثبت
2. الکترون ها به دور هسته روی مسیر دایره ای شکل می چرخند
3. تعداد الكترونهای هر مدار ثابت، از مداری به مدار دیگر تغییر می كند.
توضیحات فوق خلاصه ای از سیر نظریه ها در مورد ماده و اتم است، حال به تشریح آن می پردازیم:
در رم باستان دالتون بر این عقیده بود که اتم کوچک ترین جزء غیر قابل تجزیه ماده است و نمی توان آنرا به اجزای کوچکتری تقسیم کرد.
در اواسط قرن نوزدهم عده ای از دانشمندان با انجام آزمایش هایی تقسیم ناپذیر بودن اتم را رد كردند و پی بردند كه اتم از ذرات بسیار ریزی تشكیل شده است ( ذرات سازنده اتم به زیر اتمی معروف بود). برای نخستین بار جوزف تامسون با استفاده از لامپ پرتو كاتدی به ماهیت زیر اتمی ها پی برد.
وی به دو سر الكترود مثبت و منفی لامپ اختلاف پتانسیل الكتریكی وصل كرد و مشاهده كرد كه، پرتو كاتدی از الكترود منفی (كاتد) به الكترود مثبت (آند) می رود. در مسیر پرتو كاتدی میدان مغناطیسی قرار داد و مشاهده كرد كه پرتو كاتدی به سمت قطب مثبت منحرف می شود. هم چنین در این مسیر، توربین پرّه دار قرار داد و بر اثر برخورد پرتو به توربین، توربین شروع به حركت می كرد.
وی با تكیه بر آزمایش های خود به این نتیجه رسید كه ذرات سازنده پرتو كاتدی، دارای بارالكتریكی منفی هستند و هم چنین، علاوه بر ماهیت موجی كه پرتو دارد، ماهیت ذره ای نیز از خود نشان می دهد.
تامسون این ذرات منفی را الكترون نامید و بعدها دریافت كه ذرات سازنده پرتو كاتدی (الکترون) در تمام مواد وجود دارند.
وی با استناد بر استنتاج های خود نظریه اتمی خود را مطرح ساخت. مطابق این مدل، اتم از بار الكتریكی منفی ( الكترون ) و بار الكتریكی مثبت تشكیل شده است كه به صورت یكنواخت در سراسر اتم پخش شده است.
مدل اتمی رادرفورد:
در سال 1911 رادرفورد با انجام آزمایشی، مدل اتمی تامسون را رد کرد. او در آزمایش خود، پرتو آلفا را که دارای بار الکتریکی منفی است به ورقه نازک طلا گسیل داد. بر اثر این برخورد، بخش عظیمی از پرتو از ورقه عبور کرد، اما قسمت ناچیزی از آن براثر بر خورد منعکس و یا منحرف شد.
وی با تکیه بر این استنتاج، مدل اتمی خود را به این صورت بیان کرد که: بخش عظیمی از فضای اتم خالی است و به همین دلیل بخش عظیمی از پرتو آلفا بدون انحراف از اتم عبور می کند، اما قسمت ناچیزی از اتم توپر و متراکم است که دارای بار الکتریکی مثبت است و هنگامی که پرتو آلفا به آن برخورد می کند منعکس می شود و یا هنگامی که از نزدیکی آن عبور می کند منحرف می شود.
در اطراف این منطقه ی توپر "هسته اتم" الکترون ها پراکنده شده اند و علت آن که چرا هنگامی که پرتو آلفا از فضای اطراف هسته عبور می کند و از کنار الکترون ها بدون هیچ انحرافی به مسیر خود ادامه می دهند، آن است که در یک اتم اندازه بارالکتریکی مثبت هسته با مجموع اندازه بار الکتریکی منفی الکترون های اطراف آن برابر است. پس مطابق مدل اتمی رادرفورد، اتم از هسته که دارای بار الکتریکی مثبت است و در مرکز اتم قرار دارد و هم چنین الکترون که در اطراف هسته قرار دارد، تشکیل شده است.
برای آشنایی بیشتر با مدل اتمی رادرفورد می توانید این فلش را ببنید.
مدل بور: با پذیرفتن مدل اتمی رادرفورد این سوال برای دانشمندان پیش آمد: که
طیف نشری خطی اتم عناصر، حاصل از چیست ؟
(هر فلز طیف نشری خطی خاص خود را داراست و مانند اثر انگشت می توان از این طیف برای شناسایی فلز مورد نظر بهره گرفت)
از طرف دیگر مدل اتمی رادرفورد الكترون ها را در حال چرخش به دور هسته فرض كرد. در حالی كه الكترون ذرهی دارای بار الكتریكی است و بر اساس قوانین الكترودینامیك حركت شتاب دار ذرات دارای بار الكتریكی از جمله الكترون با انتشار امواج الكترو مغناطیسی و در نتیجه كاهش انرژی ذرهی متحرك همراه است. بنابراین الكترون ضمن چرخش به دور هسته باید به تدریج و مارپیچوار به هسته نزدیک شده و جذب هسته شود در صورتی که واقعیت غیر از این است بنابراین مدل اتمی رادرفورد ارزش خود را از دست میدهد.
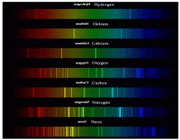
مدل اتمی بور توانست به ما نشان دهد که طیف نشر خطی که از اتم عناصر گسیل می شود:
که اگر این نور آزاد شده را از منشور عبور دهیم طیف نشری آن مشخص می شود.
ارساییهای مدل اتمی بور
1ـ نظریه اتمی بور قادر به توجیه طیف اتم ها و یون های چند الكترونی نبود و تنها طیف هیدروژن و یون های تک الكترونی بوسیله نظریه اتمی بور قابل بررسی بودند.

3ـ مدل اتمی بور توجیه قابل قبولی برای پیوند كووالانسی، شكل مولكول ها و زاویه میان پیوندها ارائه نمیدهد و در نتیجه از تفسیر بسیاری از خواص فیزیكی و شیمیایی عاجز ماند.
ظهور مكانیك موجی، نظریه بور را كه بر مبنای خواص ذرهای الكترون بود دگرگون ساخت.
و اما کامل ترین مدل اتمی:
مدل کوانتومی اتم
این مدل توسط اروین شرودینگر مطرح شد. وی در این مدل از حضور الکترون در فضایی سه بعدی به نام اوربیتال سخن به میان آورد. همان گونه که برای مشخص کردن موقعیت یک جسم در فضا به سه عدد (طول ، عرض و ارتفاع) نیاز است، برای مشخص کردن هر یک از اوربیتال های یک اتم نیز به چنین داده هایی نیاز داریم. شرودینگر به این منظور از سه عدد M و L و n استفاده کرد که عددهای کوانتومی خوانده می شوند.
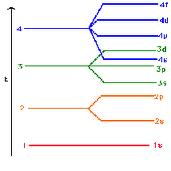
عدد کوانتومی اصلی (n):
عددی است که بور برای مشخص کردن ترازهای انرژی یا همان لایه های الکترونی بکار برد. 1= n پایدارترین لایه انرزی را نشان می دهد. هر چه n بالاتر رود سطح انرژی لایه های الکترونی افزایش می یابد و فاصله ی آن لایه از هسته دورتر می شود. لایه های الکترونی خود از گروه های کوچک تر به نام زیر لایه تشکیل شده اند. عدد n تعداد زیر لایه های هر لایه را هم مشخص می کند. مثلاً در لایه الکترونی 2= n دو زیر لایه وجود دارد.
عدد کوانتومی اوربیتالی (L): عدد کوانتومی اوربیتالی (L) نشان دهنده ی شکل، انرژی و تعداد اوربیتال ها است.
L می تواند مقادیر 0 تا 1 - n را در بر بگیرد.
L=0: یک اوربیتال کروی S
L=1: سه اوربیتال دمبلی P
L=2: پنج اوربیتال D
L=3: هفت اوربیتال F
عدد کوانتومی مغناطیسی M : جهت گیری اوربیتال ها را در فضا معین می کند. M می تواند مقادیری از L – تا L + دارا باشد. با در نظر گرفتن محورهای X ، y ، z قرار می گیرد و به صورت pX ؛ pY ؛ pZ نشان داده می شود. برای آدرس دادن اوربیتال ها به شیوه ی زیر عمل می شود:
برای مثال 2px نشان می دهد که این اوربیتال دمبلی شکل در لایه های الکترونی دوم و در زیر لایه ی p قرار دارد و در راستای محور Xها جهت گیری کرده است.

قاعده ی هوند:
در یك زیرلایه ی دارای بیش از یك اوربیتال (مثل زیرلایه های p یا d یا f)، ابتدا اوربیتال های هم انرژی (مثل اوربیتال های pz , py , px در زیرلایه ی p)، هر یك به وسیله ی یك الكترون (با اسپین های هم سو) اشغال می شود و پس از این كه كل زیرلایه، نیمه پر گردید، آن گاه شروع به كامل شدن می نماید.

آرایش های d4 و d9 در اتم های خنثی ناپایدارند و با كسب یك الكترون (از آخرین زیرلایه ی s)، آرایش خود را به حالت های پایدار d5 و d10 می رسانند. مثلاً آرایش های الكترونی فلز كروم 24Cr و فلز مس 29Cu شامل این قاعده می شوند.
نكته:
نكته:
هر لایه الكترونی مثل لایه ی n، دارای n2 اوربیتال است و حداكثر، گنجایش 2n2 الكترون را داراست. مثلاً لایه ی اول (K)، دارای 1 اوربیتال است و حداكثر 2 الكترون را می تواند در خود جای دهد. هم چنین، لایه ی 2 (L)، دارای 4 اوربیتال است و حداكثر 8 الكترون را می تواند در خود جای دهد. لایه ی 3 (M)، نیز دارای 9 اوربیتال است و حداكثر 18 الكترون را می تواند در خود جای دهد و ...
نكته:
مطابق اصل بناگذاری (یا اصل آفبا)، برای دست یافتن به آرایش الكترونی یك اتم از روی اتم قبلی اش، می توان از روش افزودن گام به گام پروتون (به هسته) و الكترون (به پیرامون هسته)، استفاده نمود، یعنی می توان از روی اتم هیدروژن، ساختار الكترونی اتم های سنگین تر از هیدروژن را یك به یك به دست آورد.
به فضایی محدود در اطراف هستهٔ اتم که بیشترین احتمال حضور الکترون در آن است، اوربیتال میگویند.
انواع اوربیتال
اوربیتال
S اوربیتالهای S دارای تقارن کروی میباشد، تراز n=1 حداکثر دارای دو
الکترون است. بنابراین تراز فرعی 1S و 2S و 3S و... هم تقارن کروی دارند،
با این تفاوت که اندازه آنها بزرگتر از اوربیتال 1S میباشد. اوربیتال p
اوربیتال p از سه اوربیتال فرعی تشکیل شده است. هر اوربیتال p به شکل دو
کره تغییر شکل یافته است که میتوان آنها را در امتداد یکی از محورهای سه
گانه مختصات (z,y,x) تصور کرد از این رو اوربیتالهای p را با مشخص میکنند
که در سه جهت مختلف قرار گرفتهاند. اوربیتالهای p از لحاظ انرژی برابرند
و در غیاب میدان مغناطیسی نمیتوان تفاوتی بین الکترونهایی که این
اوربیتالها را اشغال کردهاند قایل شد. ولی در بررسیهای طیفی که تحت
تاثیر یک میدان مغناطیسی قرار میگیرند، هر اوربیتال p به سه خط شکافته
میشوند.اوربیتالهای d از 5 اوربیتال فرعی تشکیل شدهاند که جهت گیریهای
متفاوتی در فضا دارند ولی از لحاظ انرژی باهم همارز هستند.
اوربیتال اتمی
این نوع اوربیتال در اتمها وجود دارد و انواع ان عبات است از :s,p,d,f,g
ابر الکترونی
ابر
الکترونی اصطلاحی است که به مدل اتمی لایهای یا همان کوانتومی مربوط
میشود. این مدل که کوانتومی نام دارد میگوید که مداری برای حرکت
الکترونها به دور هسته اتم وجود ندارد و الکترونها از لایهای به لایه
دیگر میروند. در بین این حرکت و تغییر لایه فوتون (انرژی به دست آمده) خود
را به صورت نور آزاد میکنند. حال اگر محلّ تردد الکترونها را به صورت
نقطههایی مشخّص کنیم (که در حقیقت نمیتواند امکان پذیر باشد و در حدّ فرض
است) شکلی ابر مانند به وجود خواهد آمد. به این شکل ابر الکترونی گفته
میشود.
بعضی بخشهای این ابر تراکم بیشتری دارد و بعضی بخشها
تراکم کمتر. به طور کلّی اطراف نزدیک هسته و خیلی دور از هسته ترکم کمی
دارند. پس در حدّ متوسّط بیشترین موجود نمیباشد.
ایزوبارها
نوکلئیدهایی که عدد جرمی (تعداد کل نوترون و پروتون) یکسانی دارند، اما اعداد اتمی آن ها متفاوت است، ایزوبار نامیده می شوند. همان گونه که در شکل زیر نشان داده شده است، I-131 و Xe-131 ایزوبار های یکدیگرند. یک جفت ایزوبار نمی تواند به عنصر شیمیایی یکسانی تعلق داشته باشد. رابطه ی بین چند ایزوبار در نمودار نوکلئیدی زیر نشان دهنده ی آلومینیوم- 29 ، سیلیکون- 29، فسفر- 29 و گوگرد- 29 است.
رابطه ی بین چند ایزوبار در نمودار نوکلئیدی
توجه عمده ی ما به ایزوبارها آن است که در بیش تر تبدیلات رادیواکتیوی، یک نوکلئید به ایزوبار خودش تغییر خواهد یافت؛ به عنوان مثال I-131 نشان داده شده در شکل زیر، رادیواکتیو است و هنگامی که متحمل تغییرات عادی رادیواکتیوی خود می شود، به Xe-131 تبدیل می شود.
ایزومرها
هسته ها می توانند ترکیب پروتون - نوترون مشابهی داشته باشند اما کاملاً یکسان نباشند؛ به عنوان مثال، یک هسته می تواند انرژی بیش تری نسبت به هسته ی دیگر داشته باشد.
دو هسته ای که می توانند ترکیب یکسانی داشته باشند اما انرژی آن ها در حال تغییر است، ایزومر هم نامیده می شوند. یک مثال برای جفت ایزومری در شکل 6 نشان داده شده است؛ تکنسیم- 99 می تواند در دو حالت انرژی وجود داشته باشد: انرژی بالاتر برای این عنصر، یک حالت موقتی است و به حالت نیمه پایدار اشاره دارد .
نشانه ی یک نوکلئید در حالت نیمه پایدار، اضافه کردن حرف m به عدد جرمی است (Tc-99m) . هسته ها در حالت نیمه پایدار، انرژی و بار اضافی خود را در نهایت به دیگر ایزومرهای خود می دهند. چنین تبدیلات ایزومری در پزشکی هسته ای نقش مهمی دارند و در ادامه ی بحث با جزئیات بیش تری مورد بحث قرار خواهند گرفت.
ایزوتون ها
نوکلئیدهایی که تعداد نوترون مشابهی دارند، ایزوتون نامیده می شوند. به دلیل این که با این مطلب معمولاً در پزشکی هسته ای مواجه نمی شویم، این بحث را به اتمام می رسانیم.
|
نمونهای از معرفهای PH ، پر کاربرد در آزمایشگاهای شیمی
| |||
|
رنگ اسیدی - |
دامنه PH برای تغییر رنگ |
- رنگ قلیایی | |
|
آبی تیمول |
قرمز |
1.2 - 2.8 |
زرد |
|
متیل اورانژ |
قرمز |
3.1 - 4.5 |
زرد |
|
سبز برموکروزول |
زرد |
3.8 - 5.5 |
آبی |
|
سرخ متیل |
قرمز |
4.2 - 6.3 |
زرد |
|
لیتموس |
قرمز |
5 - 8 |
آبی |
|
آبی برمتیمول |
زرد |
6 - 7.6 |
آبی |
|
آبی تیمول |
زرد |
8 9.6 |
آبی |
|
فنل فتالین |
بیرنگ |
8.3 - 10 |
قرمز |
|
زرد آلیزارین |
زرد |
10 - 12.1 |
ارغوانی کم رنگ |
|
تیمول فتالئین |
بیرنگ |
9.3 - 10.5 |
آبی |
|
ایندوفنول |
قرمز |
7.1 - 9.1 |
آبی |
|
برموفنول آبی |
زرد |
3 - 4.6 |
ارغوانی |
|
مالاشیت سبز |
زرد آبی |
0 - 2 11.5 - 14 |
سبز بیرنگ |
|
آزو بنفش |
زرد |
13 - 11 |
بنفش |
مخصوص دبیر شیمی !
مهر شما ، گرافیت وجود مرا الماس کرد . من از با شما بودنم چیزی فراتر از استوکیومتری
زندگی و مولاریته شادیها آموختم . امیدوارم کلویید زندگی تان شفاف و معادلات زندگیتان
موازنه شده و محلول زندگیتان از عشق و محبت فراسیر شده باشد . با بیشترین درصد
خلوص دوستتان دارم و با بالاترین غلظت مولال ، روزتان مبارک !
مولکول آب پس از گفتن متشکرم
مولکول آب اول قبل از دعا و مولکول دومی بعد از دعا
پیوند کووالانسی
اصول کلی استخراج فلزات
بازیافت و فواید آن
|
|
. بخش اول : ماده و تغییرات آن
فصل 1 : ماده و ویژگی های آن |
|
|
. بخش دوم : انرژی، زندگی
فصل 2 : نور، رنگ ، بینایی فصل 3 : موج فصل 4 : گرما چیست |
|
|
. بخش سوم : زمین زیستگاه ها
فصل 5 : ساختار زمین فصل 6 : مواد سازنده سنگ كره فصل 7 : كاربرد سنگ ها و كانی ها فصل 8 : هوازدگی |
|
|
. بخش چهارم : دنیای زنده
فصل 9 : انسان، موجودی زنده فصل 10 : غذا و سلامتی فصل 11 : گوارش فصل 12 : خون و ایمنی فصل 13 : گردش مواد فصل 14 : تبادل با محیط |
عنصر های جدید اضافه شده به جدول مندلیف