مدل های اتمی
1.مدل دموکریت
1. ماده ساختار ذره ای دارد
2. اتم های مواد مختلف شکل های متفاوتی دارند (اتم های مواد ترش لوزی شکل و اتم های آب کروی)
2. مدل دالتون
1. ماده ساختار ذره ای دارد
2. اتم ساچمه مانند و توپر است
3. تفاوت مواد بخاطر شکل اتم های آن ها نیست.
3. مدل تامسون
1. اتم دارای بار منفی به نام الکترون است و به همان اندازه بار مثبت به نام پروتون دارد.
2. الکترون ها در خمیری از بارهای مثبت پخش شده اند مانند کیک کشمشی
4. مدل رادرفورد
1. اتم هسته ای کوچک با بار مثبت دارد
2. بیشتر حجم اتم فضای خالی است
3. الکترون ها اطراف هسته را محاصره کرده اند.
5.مدل بور
1. هسته کوچک با بار مثبت
2. الکترون ها به دور هسته روی مسیر دایره ای شکل می چرخند
3. تعداد الكترونهای هر مدار ثابت، از مداری به مدار دیگر تغییر می كند.
توضیحات فوق خلاصه ای از سیر نظریه ها در مورد ماده و اتم است، حال به تشریح آن می پردازیم:
در رم باستان دالتون بر این عقیده بود که اتم کوچک ترین جزء غیر قابل تجزیه ماده است و نمی توان آنرا به اجزای کوچکتری تقسیم کرد.
در
اواسط قرن نوزدهم عده ای از دانشمندان با انجام آزمایش هایی تقسیم ناپذیر
بودن اتم را رد كردند و پی بردند كه اتم از ذرات بسیار ریزی تشكیل شده
است ( ذرات سازنده اتم به زیر اتمی معروف بود). برای نخستین بار جوزف تامسون با استفاده از لامپ پرتو كاتدی به ماهیت زیر اتمی ها پی برد.
وی
به دو سر الكترود مثبت و منفی لامپ اختلاف پتانسیل الكتریكی وصل كرد و
مشاهده كرد كه، پرتو كاتدی از الكترود منفی (كاتد) به الكترود مثبت (آند)
می رود. در مسیر پرتو كاتدی میدان مغناطیسی قرار داد و مشاهده كرد كه پرتو
كاتدی به سمت قطب مثبت منحرف می شود. هم چنین در این مسیر، توربین پرّه دار
قرار داد و بر اثر برخورد پرتو به توربین، توربین شروع به حركت می كرد.
وی
با تكیه بر آزمایش های خود به این نتیجه رسید كه ذرات سازنده پرتو كاتدی،
دارای بارالكتریكی منفی هستند و هم چنین، علاوه بر ماهیت موجی كه پرتو
دارد، ماهیت ذره ای نیز از خود نشان می دهد.
تامسون این ذرات منفی را الكترون نامید و بعدها دریافت كه ذرات سازنده پرتو كاتدی (الکترون) در تمام مواد وجود دارند.
وی
با استناد بر استنتاج های خود نظریه اتمی خود را مطرح ساخت. مطابق این
مدل، اتم از بار الكتریكی منفی ( الكترون ) و بار الكتریكی مثبت تشكیل شده
است كه به صورت یكنواخت در سراسر اتم پخش شده است.
مدل اتمی رادرفورد:
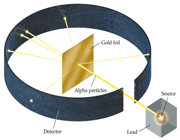
در سال 1911 رادرفورد با انجام آزمایشی، مدل اتمی تامسون را رد کرد. او در آزمایش خود، پرتو آلفا
را که دارای بار الکتریکی منفی است به ورقه نازک طلا گسیل داد. بر اثر این
برخورد، بخش عظیمی از پرتو از ورقه عبور کرد، اما قسمت ناچیزی از آن براثر
بر خورد منعکس و یا منحرف شد.
وی با تکیه بر این استنتاج، مدل
اتمی خود را به این صورت بیان کرد که: بخش عظیمی از فضای اتم خالی است و به
همین دلیل بخش عظیمی از پرتو آلفا بدون انحراف از اتم عبور می کند، اما
قسمت ناچیزی از اتم توپر و متراکم است که دارای بار الکتریکی مثبت است و
هنگامی که پرتو آلفا به آن برخورد می کند منعکس می شود و یا هنگامی که از
نزدیکی آن عبور می کند منحرف می شود.
در اطراف این منطقه ی توپر "هسته اتم" الکترون ها پراکنده شده اند و علت آن که چرا هنگامی که پرتو آلفا
از فضای اطراف هسته عبور می کند و از کنار الکترون ها بدون هیچ انحرافی به
مسیر خود ادامه می دهند، آن است که در یک اتم اندازه بارالکتریکی مثبت
هسته با مجموع اندازه بار الکتریکی منفی الکترون های اطراف آن برابر است.
پس مطابق مدل اتمی رادرفورد، اتم از هسته که دارای بار الکتریکی مثبت است و
در مرکز اتم قرار دارد و هم چنین الکترون که در اطراف هسته قرار دارد،
تشکیل شده است.
برای آشنایی بیشتر با مدل اتمی رادرفورد می توانید این فلش را ببنید.
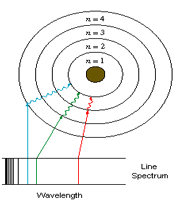
مدل بور: با پذیرفتن مدل اتمی رادرفورد این سوال برای دانشمندان پیش آمد: که
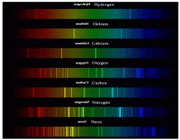
طیف نشری خطی اتم عناصر، حاصل از چیست ؟
(هر فلز طیف نشری خطی خاص خود را داراست و مانند اثر انگشت می توان از این طیف برای شناسایی فلز مورد نظر بهره گرفت)
از
طرف دیگر مدل اتمی رادرفورد الكترون ها را در حال چرخش به دور هسته فرض
كرد. در حالی كه الكترون ذرهی دارای بار الكتریكی است و بر اساس قوانین
الكترودینامیك حركت شتاب دار ذرات دارای بار الكتریكی از جمله الكترون با
انتشار امواج الكترو مغناطیسی و در نتیجه كاهش انرژی ذرهی متحرك همراه
است. بنابراین الكترون ضمن چرخش به دور هسته باید به تدریج و مارپیچوار به
هسته نزدیک شده و جذب هسته شود در صورتی که واقعیت غیر از این است
بنابراین مدل اتمی رادرفورد ارزش خود را از دست میدهد.
بور
با پذیرفتن مدل اتمی رادرفورد چنین پیشنهاد داد که: الکترون ها در اطراف
هسته اتم در سطوح انرژی مشخصی قرار دارند و در این سطوح به دور هسته اتم در
حال چرخیدن هستند. انرژی الکترون هایی که در سطوح انرژی پایین تر به هسته
نزدیک تر هستند، نسبت به الکترون هایی که از هسته دورند، انرژی کم تری
دارند.
پس برای انتقال الکترون از سطح انرژی
پایین به سطح انرژی بالا، باید انرژیی معادل اختلاف انرژی بین آن دو سطح
را به آن الکترون بدهیم. پس انرژی الکترون ها در یک اتم کوانتیده است.
مدل اتمی بور توانست به ما نشان دهد که طیف نشر خطی که از اتم عناصر گسیل می شود:
بر
اثر انتقال الکترون ها از سطوح انرژی بالا به سطوح انرژی پایین است که در
این انتقال انرژی الکترون کاهش و به صورت نور و گرما آزاد می شود
که اگر این نور آزاد شده را از منشور عبور دهیم طیف نشری آن مشخص می شود.
ارساییهای مدل اتمی بور
1ـ نظریه اتمی بور قادر به توجیه طیف اتم ها و یون های چند الكترونی نبود و تنها طیف هیدروژن و یون های تک الكترونی بوسیله نظریه اتمی بور قابل بررسی بودند.
2ـ
با بررسی دقیقتر طیفهای اتمی، نشان داده شد كه هر خط طیفی خود از چند خط
نزدیک به هم تشكیل میشود بنابر این هر تراز الكترونی كه بور آن را
دایرهای میپنداشت شامل تعدادی ترازهای نزدیک به هم است. به عبارت دیگر بور زیرلایهها را مورد توجه قرار نداد.
3ـ
مدل اتمی بور توجیه قابل قبولی برای پیوند كووالانسی، شكل مولكول ها و
زاویه میان پیوندها ارائه نمیدهد و در نتیجه از تفسیر بسیاری از خواص
فیزیكی و شیمیایی عاجز ماند.
ظهور مكانیك موجی، نظریه بور را كه بر مبنای خواص ذرهای الكترون بود دگرگون ساخت.
و اما کامل ترین مدل اتمی:
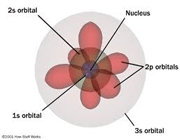
مدل کوانتومی اتم
این مدل توسط اروین شرودینگر
مطرح شد. وی در این مدل از حضور الکترون در فضایی سه بعدی به نام اوربیتال
سخن به میان آورد. همان گونه که برای مشخص کردن موقعیت یک جسم در فضا به
سه عدد (طول ، عرض و ارتفاع) نیاز است، برای مشخص کردن هر یک از اوربیتال
های یک اتم نیز به چنین داده هایی نیاز داریم. شرودینگر به این منظور از سه
عدد M و L و n استفاده کرد که عددهای کوانتومی خوانده می شوند.
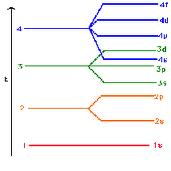
عدد کوانتومی اصلی (n):
عددی است که بور برای مشخص کردن ترازهای انرژی
یا همان لایه های الکترونی بکار برد. 1= n پایدارترین لایه انرزی را نشان
می دهد. هر چه n بالاتر رود سطح انرژی لایه های الکترونی افزایش می یابد و
فاصله ی آن لایه از هسته دورتر می شود. لایه های الکترونی خود از گروه های
کوچک تر به نام زیر لایه تشکیل شده اند. عدد n تعداد زیر لایه های هر لایه
را هم مشخص می کند. مثلاً در لایه الکترونی 2= n دو زیر لایه وجود دارد.
عدد کوانتومی اوربیتالی (L): عدد کوانتومی اوربیتالی (L) نشان دهنده ی شکل، انرژی و تعداد اوربیتال ها است.
L می تواند مقادیر 0 تا 1 - n را در بر بگیرد.
L=0: یک اوربیتال کروی S
L=1: سه اوربیتال دمبلی P
L=2: پنج اوربیتال D
L=3: هفت اوربیتال F
عدد کوانتومی مغناطیسی M : جهت گیری اوربیتال ها
را در فضا معین می کند. M می تواند مقادیری از L – تا L + دارا باشد. با
در نظر گرفتن محورهای X ، y ، z قرار می گیرد و به صورت pX ؛ pY ؛ pZ نشان
داده می شود. برای آدرس دادن اوربیتال ها به شیوه ی زیر عمل می شود:
برای
مثال 2px نشان می دهد که این اوربیتال دمبلی شکل در لایه های الکترونی دوم
و در زیر لایه ی p قرار دارد و در راستای محور Xها جهت گیری کرده است.
عدد کوانتومی مغناطیسی اسپین MS : مربوط بهجهت حرکت الکترون به دور خودش است. دانشمندان افزون بر حرکت اوربیتالی، یک حرکت اسپینی نیز به الکترون نسبت داده اند (حرکت الکترون به دور خود MS تنها دو مقدار ½+ برای چرخش در جهت عقربه های ساعت و ½- برای چرخش در خلاف جهت حرکت عقربه های ساعت دارد)
قاعده ی هوند:
در
یك زیرلایه ی دارای بیش از یك اوربیتال (مثل زیرلایه های p یا d یا f)،
ابتدا اوربیتال های هم انرژی (مثل اوربیتال های pz , py , px در زیرلایه ی
p)، هر یك به وسیله ی یك الكترون (با اسپین های هم سو) اشغال می شود و پس
از این كه كل زیرلایه، نیمه پر گردید، آن گاه شروع به كامل شدن می نماید.

نكته:
آرایش های d4 و d9 در اتم های خنثی ناپایدارند و با كسب یك الكترون (از آخرین زیرلایه ی s)، آرایش خود را به حالت های پایدار d5 و d10 می رسانند. مثلاً آرایش های الكترونی فلز كروم 24Cr و فلز مس 29Cu شامل این قاعده می شوند.
نكته:
مطابق
اصل طرد پائولی، در یك اتم، هیچ گاه نمی توان دو الكترون پیدا نمود كه هر
چهار عدد كوانتومی آن ها یكسان باشند. به عبارت دیگر، در یك اتم، هیچ
اوربیتالی نمی تواند بیش از دو الكترون را در خود جای دهد.
نكته:
هر لایه الكترونی مثل لایه ی n، دارای n2 اوربیتال است و حداكثر، گنجایش 2n2 الكترون
را داراست. مثلاً لایه ی اول (K)، دارای 1 اوربیتال است و حداكثر 2
الكترون را می تواند در خود جای دهد. هم چنین، لایه ی 2 (L)، دارای 4
اوربیتال است و حداكثر 8 الكترون را می تواند در خود جای دهد. لایه ی 3
(M)، نیز دارای 9 اوربیتال است و حداكثر 18 الكترون را می تواند در خود جای
دهد و ...
نكته:
مطابق اصل بناگذاری
(یا اصل آفبا)، برای دست یافتن به آرایش الكترونی یك اتم از روی اتم قبلی
اش، می توان از روش افزودن گام به گام پروتون (به هسته) و الكترون (به
پیرامون هسته)، استفاده نمود، یعنی می توان از روی اتم هیدروژن، ساختار
الكترونی اتم های سنگین تر از هیدروژن را یك به یك به دست آورد.